
元素周期表有7个周期,16个族。
每一个横行叫作一个周期,每一个纵行叫作一个族。
这7个周期又可分成短周期(1、2、3)、长周期(4、5、6、7)。共有16个族,又分为7个主族(ⅠAⅡA ⅢA ⅣA ⅤA ⅥA ⅦA), 7个副族(ⅠB ⅡB ⅢB ⅣB ⅤB ⅥB ⅦB),一个第Ⅷ族(包括三个纵行),一个零族。
主族元素是化学上对元素的一种分类,是指周期表中s区及p区的元素。主族元素另外一种定义是除了最外层电子层以外的电子层的电子数都是满电子的化学元素。周期表中除了过渡金属、镧系元素、锕系元素、惰性气体之外的都是主族元素。
第一主族:氢锂钠钾铷铯钫
第二主族:铍镁钙锶钡镭
第三主族:硼铝镓铟铊
第四主族:碳硅锗(zhě)锡铅
第五主族:氮磷砷锑(tī)铋(bì)
第六主族:氧硫硒碲(dì)钋(pō)
第七主族:氟氯溴碘砹

元素周期表上的0族元素属于稀有气体(惰性气体)。在常温常压下,它们都是无色无味的单原子气体,很难进行化学反应。稀有气体共有七种,它们是氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)、氡(Rn,放射性)、气奥(Og,放射性,人造元素)。
化学元素周期表元素位置推断:
1. 元素周期数等于核外电子层数;
2. 主族元素的序数等于最外层电子数;
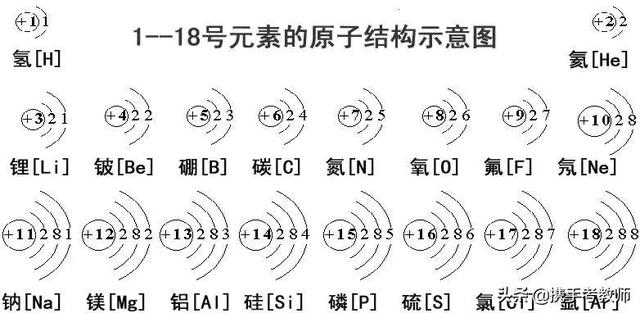
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子半径增大,原子序数递增,元素金属性递增,非金属性递减。
核电荷数=质子数=核外电子数=原子序数
相对原子质量≈质子数 中子数(不可作为公式)
,











