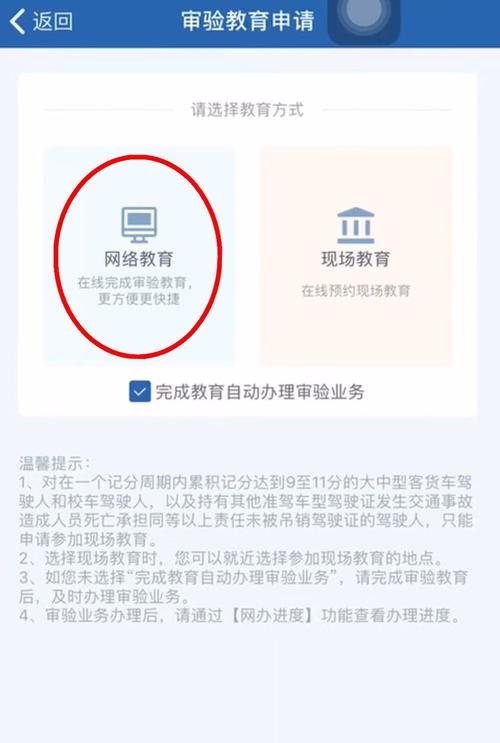
(1)分子为硬球型
(2)反应分子A和B必须碰撞才能发生反应
(3)只有那些能量超过普通分子的平均能量且空间方位适宜的活化分子 的碰撞,即“有效碰撞”才能起反应。
据此结合气体分子运动论,导出气相双分子反应的速率常数(k)有如下定量公式:k=N0(rA+rB)2[8πRT(1/MA+1/MB)]1/2e-E/RT=BT1/2e-E/RT 其中N0为阿佛伽德罗(Avogadro)常量,rA、rB为分子半径,MA、MB为分子质量,E为临界能(或称阈能),R为理想气体常量,T为热力学温度,B是与温度无关的常数。
具有足够能量的反应粒子互相碰撞并且分解化学键才会产生化学反应,这就是碰撞理论,如果没有这种能量,粒子们只不过是互不伤害地跳来蹦去而已。
1918年,路易斯(Lewis)运用气体分子运动论的成果,提出了反应速率的碰撞理论。
该理论认为,反应物分子之间的相互碰撞使反应进行的先决条件。反应物分子碰准的频率越高,反应速率越大。